
 我要投稿
我要投稿
穴位敏化现象及其生物学意义
朱 兵
(中国中医科学院针灸研究所,北京100700)
穴位理论出自《灵枢·经筋》篇的“以痛为输”。《灵枢·背腧》谓之“欲得而验之,按其处,应在中而痛解,乃其腧也”。因此,古人在寻穴时不是按图或骨度定位,而是“验之”以定位。从腧穴发展与演变的历史过程中可以看出,阿是穴是腧穴概念发展的萌芽阶段,由此之后,腧穴理论从没有明确定位、无固定穴名的初级阶段,逐渐演化并最终完善到有固定位置、特定穴名,继而归属到相应的经脉腧穴系统 阶段;另有部分穴位未纳入经穴系统而保留为经外 奇穴[1]。
1 穴位是与疾病发生纠缠反应的体表位域
早年北京医学院[2]一项研究中观察到家兔胃黏膜损伤可在耳郭检测到低电阻点,其数目和面积与黏膜损伤严重度成正比。我们[3]在1999年以脊髓背角广动力型(wide dynamic range,WDR)神经元对针刺的反应为观察指标,在给予反复刺激后出现其外周感受野范围明显扩大的现象,由此推断这可能是长时间刺激造成神经源性炎性反应引起。随着研究的逐渐深入,我们认为穴位的功能状态不是固定不变的,是“活的”[4]:会因其靶器官机能状态的不同而改变其“开/合”性质和强弱;穴位是反映与调节脏器功能的特定具体部位,具有诊查和治疗的双重功效。相关穴位与其所属靶器官原始体节的同一性形成了相对紧密的联系,这种关联构成了穴位特异性的形态机能学基础[5]。陈日新团队[6]通过大量临床观察发现疾病状态下穴位存在对热敏感化现象,有时在相关穴位还会出现皮肤丘疹、凹陷、索状硬结等改变[7-8]。内脏病变[9]、甚至截肢术后[10]体表也可出现反应点,一些肠易激综合征患者也常常伴有肌痛觉异常[11]。反之,某些体表异常有时同样引发内脏反应,例如穴位的强刺激也可经背根反射使相关脏器发生炎性反应[12-13]。这种内脏病理学改变诱发的体表牵涉性“敏感反应点”同穴位的起源如出一辙,是对“反应点”显现规律和常居部位的理论总结。随着疾病趋于缓解、愈合,体表的敏化现象会减弱直至消失,这一过程表明“敏化”是穴位从正常的“静息”(silent)态到靶器官病变的“激活”(active)态的质变。腧穴的本质是一种敏化态,而不仅表现为一成不变的定位。相关研究表明,热敏部位和穴位重合率达到48.76%[6],与压痛点符合率为76%[14]、40%[15]和95%[16],同触发点的一致性为92%。
显而易见,所谓“穴位敏化”指的是体表特定区域发生了感觉异变,使得其对各种刺激敏感度增加(类似于“Allodynia”)。其他与此相关的物理、化学特征的改变只是伴随相生的反应。一味扩大、泛化“穴位敏化”的概念无助于问题的解决,反而混淆了研究的主题。
临床研究证明,敏化现象不单是特殊的病理表象,还是针灸施治的有效位点,具有提高临床疗效的效果[4]。也就是说,穴位是疾病状态下特异的、动态的、敏化态的体表反应部位,同时也是调控人体功能达到预防治疗目的的针灸刺激位域。
2 穴位敏化现象在疾病情况下的发生和分布有明显规律性
我们针对20种内脏疾病和10种肌筋膜系统疾病在20余家医院对符合纳入病种前来就诊的病人逐一进行病例探查并标记敏感点,在人体挂图上标记出反应点出现的部位和范围,与穴位分布进行比对,取得了第一手的临床资料[5]。
通过对千余位心绞痛患者采用按压诊法和压痛仪检测法标记上肢和胸背部敏感点并与穴位位置对比观察表明,多数患者伴随左上肢内侧疼痛和不适感,胸前区出现的牵涉痛多呈片状,而上肢出现的牵涉痛多呈带状、条索状和点状。多数患者的牵涉痛区范围较大,常有数个敏感点分布。患者的压痛区多分布于左胸范围,常波及到左肩背区和左上肢,偶见散在分布于其他部位。在较大的敏感点区,常存在压痛中心区。其性质多为钝痛、胀痛、酸痛、痒痛和放散痛,部分患者对牵涉痛部位按压有舒然感。压痛区在胸前与肩背部较大,上肢较小,多呈条带状并与肢体平行分布。
至少出现一个压痛点的患者比率高达94%,左胸部出现比率最高,其次出现在左上肢尺侧面,类似于心经、心包经的循行部位(图1)。
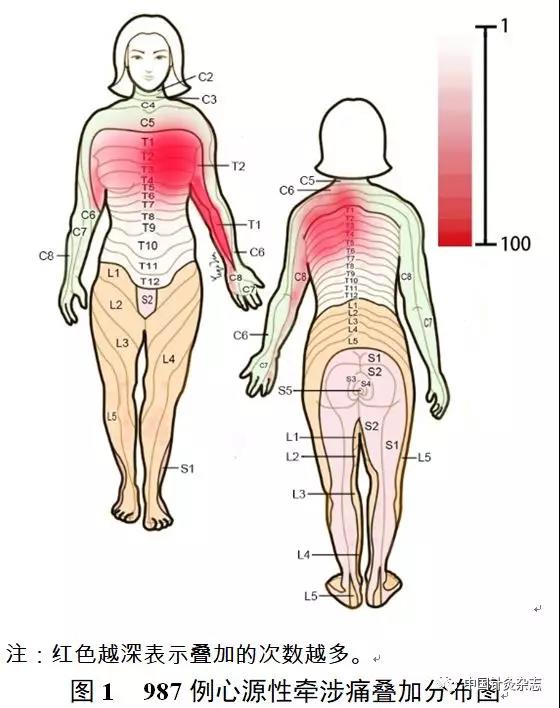
心源性牵涉痛主要分布有常用于治疗心胸疾病的穴位。在上肢尺侧面有心包经和心经的10余个穴位。在颈部、胸部和肩背部,敏化区涉及到多条经脉的数十个经穴、经外奇穴和新穴(图2),这些不同来源的穴位都可用于治疗心胸系统的疾病。
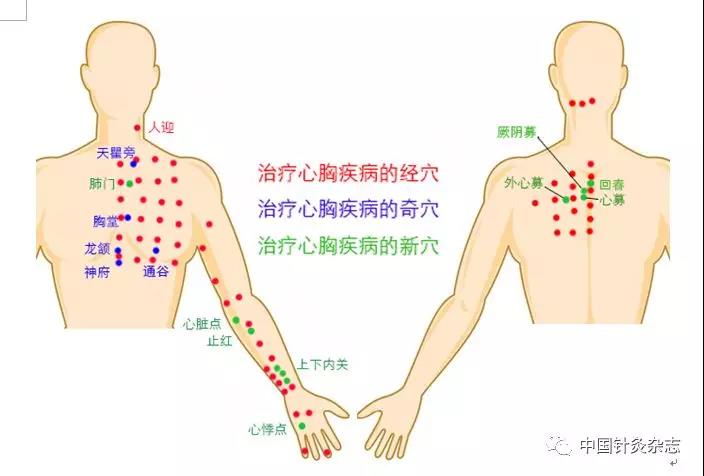
图2 位于心源性牵涉痛区分布的穴位也是治疗常用穴位
在动物实验中,可观察到急性心肌缺血的动物模型经尾静脉注射伊文氏蓝(Evans Blue,EB)出现的渗出反应。这些渗出点也多在左侧胸部出现,左背部和左上肢也有出现[5],与临床心绞痛患者发生牵涉痛的部位基本相吻合。
通过对738位胃十二指肠溃疡患者采用压诊检查腹部和下肢敏感点及分析与穴位的关系,发现92%患者主诉有胃脘部疼痛,下肢敏感点较少。这些患者大多数主诉出现牵涉痛,但胸腹背部压痛点(或区)范围较弥散,常有多个敏感点出现(图3)。
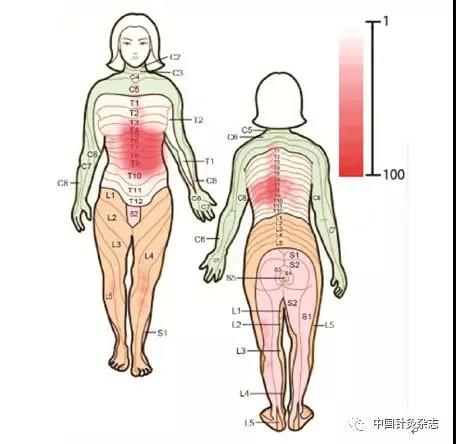
图3 胃十二指肠溃疡患者出现的牵涉痛分布区与治疗该病的常用穴位基本一致
3 神经源性牵涉性感觉异变是穴位敏化的动因
人们已经知道,伤害感受器在一些病理情况下对刺激反应的阈值会降低,导致可塑性改变,即敏化。这种现象可能与沉默神经元被唤醒为响应神经元有关[1],或者是神经元的外周纤维的寂静分支被激活造成感受野面积病理性扩大,还存在神经元的反应阈值降低和/或过度反应,最终使伤害性信息传递变得更强烈而广泛[1]。然而,敏化过程中的炎性反应是机体的一种防御性保护措施:即通过增加感受器的敏感度使病变部位得到保护,以防继续伤害[17]。在炎性反应时,肥大细胞释放炎性介质如组织胺(histamine,HA)、5-羟色胺(5-hydroxytryptamine,5-HT)、前列腺素(prostaglandin,PG)、缓激肽(bradykinin,BK)、P物质(substanceP,SP)以及神经生长因子(nerve growth factor,NGF)等,从而使这些感受器浸泡在一个称之为“炎性汤(inflammatory soup)”的分子池中。上述炎性介质调节与伤害性信息传递相关的离子通道,继而激活细胞内信号级联反应[18-19],形成新的离子跨膜通道[20-21]。
为进一步探讨病理状态下穴位的动态变化,我们采用不同内脏器官和骨-关节软组织损伤的动物模型,通过牵涉痛反应机制,观察经尾静脉注射Evans Blue染料在体表的分布与相关器官病变的关系,以及这种反应与内脏损伤程度的量效性关系[22]。
经直结肠导入不同剂量的芥子油造成大鼠肠道损伤,观察体表渗出点大小与数量的关系,探讨不同病理状态与敏化强度的关系。我们观察到,随着剂量的增加渗出点数量也随之增加,说明皮肤炎性渗出反应与器官的病变程度成正比(图4)。
在大鼠的L1~L3脊髓背角WDR神经元,我们观察到神经元的外周感受野可随着直肠注射芥子油诱发的炎性损伤而扩大,感受野面积增大的比例与直肠的损伤程度呈正相关(图5)。
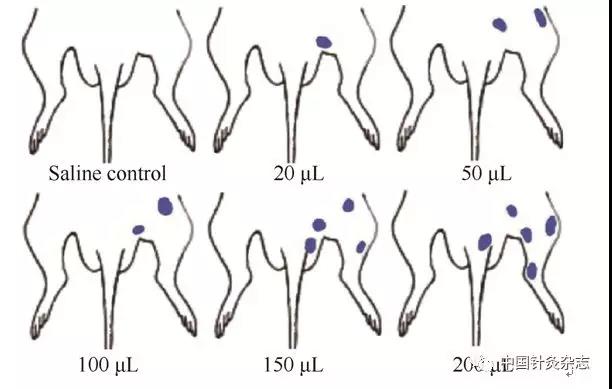
图4 直肠黏膜注射芥子油后大鼠体表出现的Evans Blue染料分布区随着剂量的加大,渗出点也随之增加
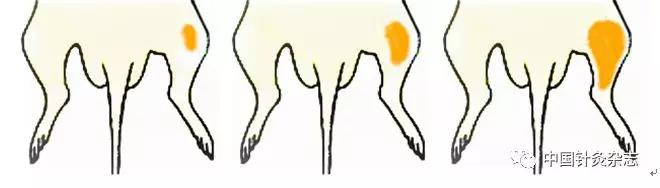
图5 在直肠炎性刺激时,大鼠脊髓背角广动力型神经元外周感受野“足三里”穴区变化
在实验研究中,内脏炎性损伤引发的体表规律性的敏化点(区),这些敏感点处的HA、5-HT、BK、SP、瞬时受体电位香草酸亚型1(TRPV-1)以及降钙素基因相关肽(CGRP)等受体具有高聚集特征,其中5-HT受体、缓激肽-1/2受体分布在毛囊周围,SP受体分布在皮下,这些可能是穴位敏化和内脏病变诱发体表痛觉过敏的物质基础(图6至图9)[1]。这些结果表明穴位在致敏因素作用下局部微理化环境发生了明显变化而形成了具有特定生物学效应的自身“穴位敏化池”[23-25]。
4 穴位敏化引起的交感–感觉偶联是触发机体自愈过程的重要始动因素
在慢性心肌缺血大鼠模型,我们观察到同节段背根神经节及敏化区皮肤发生交感芽生现象,并与感觉神经形成偶联结构,同时这种交感芽生的程度随疾病的自我恢复而呈现动态变化。慢性病变引起的交感芽生及交感-感觉偶联是体表感觉-交感神经在解剖结构层面的体现,其意义在于诱发躯体/内脏向中枢传导并放大相关损伤信息,以促进机体的自我修复。我们的实验观察到,敏化的体表部位感觉神经的自发活动可以增加同节段的交感神经放电;敏化穴位的机械、针刺和热灸等刺激可进一步增强交感神经的兴奋性反应,从而能够加快对其支配的内脏器官进行调控与愈合(图10)。
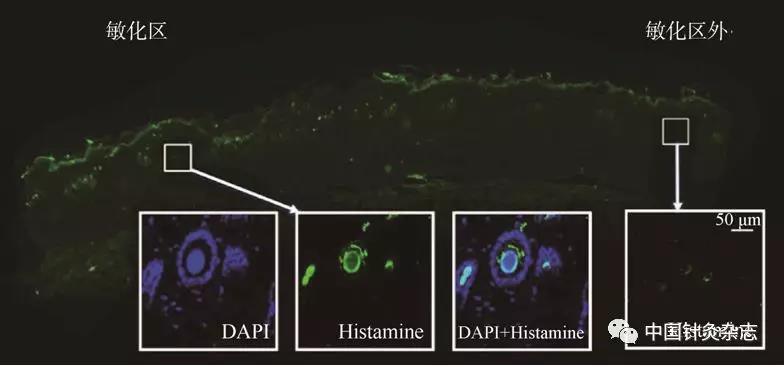
注:图的右侧为穴位外非敏化区,少见绿色荧光反应(蓝色为DAPI标记的细胞核)。
图6 大鼠胃黏膜损伤导致的HA阳性细胞和纤维在敏化穴区的表达
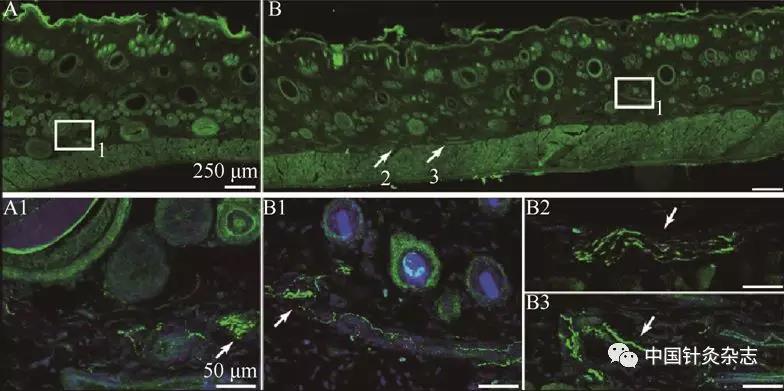
注:在敏化部位表皮、毛囊及血管周围观察到SP阳性标记的神经纤维,绿色为SP免疫阳性标记(白色箭头所指),蓝色为DAPI标记的细胞核。A为生理盐水对照区,B1为旁开非敏化穴区,B2、B3为敏化穴区。可见敏化穴区P物质阳性标记的神经纤维多于非敏化区和生理盐水对照区。
图7 大鼠胃黏膜损伤导致的SP阳性细胞和纤维在敏化穴区的表达
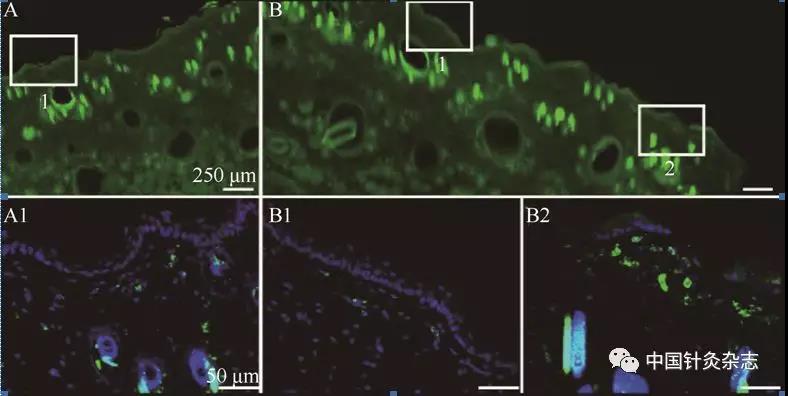
注:绿色为5-HT免疫阳性标记细胞,蓝色为DAPI标记的细胞核。A为生理盐水对照区,B1为旁开非敏化穴区,B2为敏化区。可见敏化穴区表皮下5-HT阳性标记细胞的表达增加。
图8 大鼠胃黏膜损伤导致的5-HT阳性细胞和纤维在敏化穴区的表达
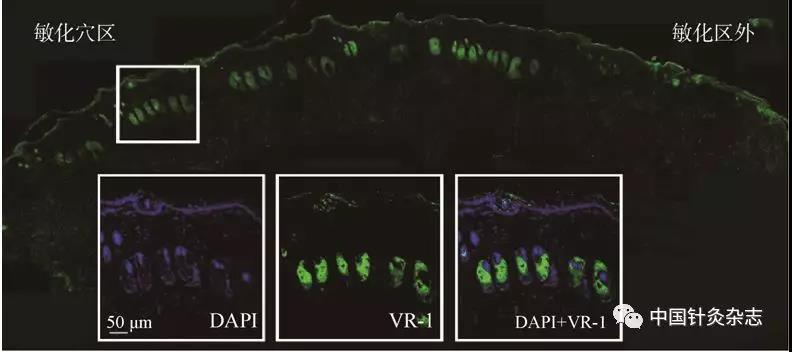
注:绿色为TRPV-1免疫阳性标记的皮脂腺细胞膜及角质细胞膜,蓝色为DAPI标记的细胞核,方框为敏化穴区局部放大。敏化区TRPV-1免疫阳性标记的角质细胞和神经终末较旁开非敏化区增多。TRPV-1表达增加表明该受体活动增强,因而可能对穴位的刺激引起的反应更大,调控机能更强。
图9 大鼠胃黏膜损伤导致的TRPV-1阳性细胞和纤维在敏化穴区的表达
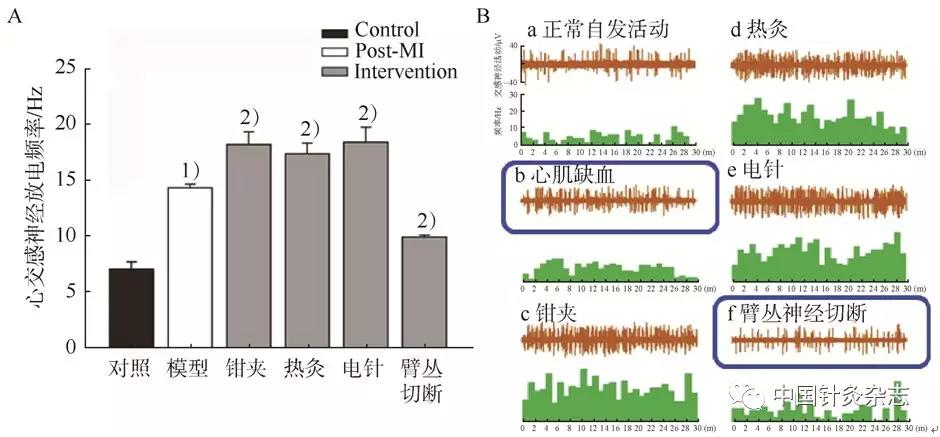
图10 穴位敏化情况下发生了交感–感觉偶联
注:A为大鼠心肌缺血模型颈上神经节心支放电统计,与对照组比较,1)P<0.001;与模型组比较,2)P<0.05。B为神经放电图。a:正常组动物自发放电,b:心肌缺血造模后心交感神经活动增加,c:在此基础上前肢尺侧部钳夹刺激可以进一步激活交感神经,d和e:热灸和电针也可以激活交感神经,f:去除臂丛神经后模型大鼠交感神经心支放电明显减少,表明在心肌缺血情况下,来自体表相应部分的躯体传入能够易化相关内脏的交感神经活动。
5 穴位敏化现象形成的中枢机制
1983年Woolf率先在研究痛觉过敏患者观察到中枢敏化现象[26]。30多年来,人们逐渐认识到脊髓水平的机能、化学和结构的可塑性改变能够引起中枢痛觉感受系统敏化,导致痛觉过敏[27]。目前已经清楚的是,脊髓背角神经元[28]、丘脑、中脑灰质及大脑皮质神经元均参与痛觉的中枢敏化过程[29]。
Latremoliere和Woolf[30]观察了内脏炎性刺激与诱发中枢敏化现象的关系。他们发现脊髓背角神经元的敏感度和感受野在局部注射芥子油出现了动态改变。神经元的激活区在注射芥子油诱发敏化后扩大了好几倍,原先对触摸刺激轻度激活的单位也明显增加了反应强度,发生触诱发痛现象。
当内脏发生疾病时,体表相应穴位引发的感觉异常的敏化现象与牵涉痛有相似之处。牵涉痛的会聚-易化学说认为,病变器官和出现牵涉痛的皮肤受相同的脊神经后根传入纤维支配,共同终止于灰质后角的相同区域。因此,当内脏发生病变时,来自该内脏的大量冲动进入后角,形成一个局部的兴奋灶,使该处刺激阈值下降。关于牵涉痛的电生理学研究已经初步揭示脊髓和脊髓上中枢的躯体-内脏会聚神经元可以被来自内脏的伤害性刺激敏化,使该会聚神经元对体表的传入产生更强烈的反应。这为解释穴位敏化现象提供了科学依据[31]。
近年来,我们采用电生理学方法对穴位的敏化现象进行了一系列研究,得到了一些新颖的资料,有助于深化我们对穴位本态的认识,阐述穴位功能从相对“静寂”到相对“激活”的动态变化规律,探讨敏化穴区的量-效关系及其相关的各级中枢机制。
在大鼠的T12脊髓节段记录的背角WDR神经元,我们观察到正常情况下这类神经元仅表现为散在的自发活动,针刺其感受野区域的“中脘”穴可明显激活该神经元;给予胃黏膜局部注射芥子油后,神经元对“中脘”穴针刺引起的反应比注射芥子油前增加70%以上。在大鼠的延髓背侧网状亚核(subnucleus reticularis dorsalis,SRD)的全身会聚神经元,针刺“中脘”穴该类神经元活动显著激活;胃黏膜局部注射芥子油后,在此基础上SRD神经元对“中脘”穴针刺引起的反应增加了2/3。这些结果表明在内脏病变情况下,穴位已从正常状态下的相对“沉寂”状态进入病理状态下的相对“激活”状态(图11)。
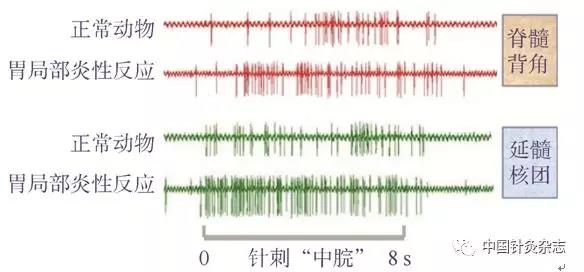
图11 胃黏膜注射芥子油后,大鼠脊髓背角WDR神经元和延髓SRD神经元对穴位针刺引起的反应明显增加
为了进一步阐述内脏伤害性传入对不同中枢神经元的易化作用及其与穴位敏化的关系,我们分别记录大鼠脊髓L1~L3节段背角WDR神经元、延髓背柱核(dorsal columnar nucleus,DCN)神经元、SRD神经元和丘脑的腹后外侧核(ventralposterior lateral nucleus,VPL)神经元活动,在神经元放电频率稳定后给予直结肠条件式扩张(colorectal distension,CRD)刺激后,观察穴位刺激对生理病理状态下不同中枢神经元的激活作用,研究穴位敏化的中枢机制[32-35]。
给予CRD刺激后,上述4个中枢核团的神经元对穴位刺激均发生明显的激活增加效应(图12),说明了对内脏施予伤害性刺激后,穴位对针刺发生了易化作用,增强了来自穴位的传入反应,亦即发生了穴位敏化现象。由此证实,这些中枢神经元在伤害性传入引起的易化作用与穴位敏化的中枢机制密切相关。
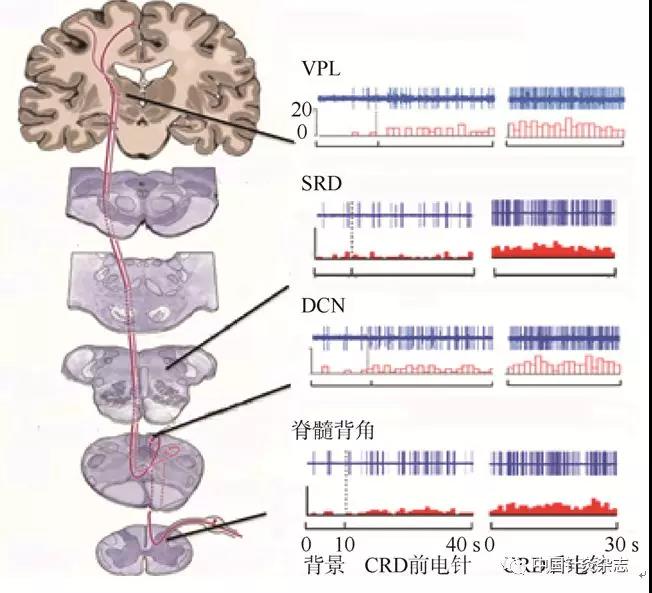
注:脊髓背角、延髓背柱核(DCN)、延髓背侧网状亚核(SRD)和丘脑腹后外侧核(VPL)神经元被直结肠伤害性传入(CRD)易化。
图12 直结肠伤害性传入加大来自体表穴区刺激引发的敏化级联反应
6 穴位敏化是影响针灸效应的关键因素
针灸学科的核心问题是腧穴,而穴位的敏化现象指的是从生理的“静息态”转变为病理的“激活态”过程。简言之,机体发生病理改变时,相应的体表会出现以神经源性炎性反应为主的病理学改变,而这种反应发生的具体部位亦即为“穴位”;它不是简单的一个反应“point”,而是一块与靶器官相互纠缠的“territories”(图13)。
在前期研究报道的基础上,结合本课题组多年的动物实验研究及大样本、多中心临床病例观察,可见:所谓穴位敏化,是指机体在病理状态下发生以神经源性炎性反应为主要特征、以“穴区敏化池”中的炎性介质为内源性调控启动因子的生物学程序。当它在向体表特定部位(如穴位)发出预警信号(牵涉性感觉异常)时,引发以下两种反应:①出现了以酸、胀、痒、麻、痛等为特征的敏化信号,这是一种非常奇妙的感觉异变,能促使和诱导我们主动寻求和欣然接受诸如摩擦、抓捏、热熨等这类的局部刺激,这种现象在日常生活中比比皆是;②同步激活了机体本能稳态调节的级联反应(cascade),触发病变的自我愈合与修复过程。
根据我们目前的研究,这种自我修复的级联调控包括以下4个方面:①由于敏化现象是C-多型感受器-纤维激活的阈值降低和自发活动增强,而且更容易被正常不能引起该类感受器活动的触压等机械刺激而激活(allodynia),它在导致局部痛觉过敏的同时也向中枢神经系统传递触发痛觉调制的“弥漫性伤害抑制性控制”系统,通过下行抑制通路发挥全身性镇痛效应;与此同时,这种传入也可激活自主神经的躯体-交感反射活动,发挥对内脏功能的调节[36]。②敏化促进皮肤角质细胞等合成、分泌号称“万灵药”的糖皮质激素等内分泌物质,发挥广谱的生物学调控效应。③敏化能够刺激皮肤细胞合成、分泌与免疫相关的细胞因子,而免疫反应是多数疾病病理学变化的共性物质基础。④敏化部位相关的节段背根神经节发生交感芽生现象,并与感觉神经形成偶联,诱发相应节段的交感神经活动,以促进内脏器官的自我修复;敏化穴位的机械、针刺和热灸等刺激可进一步增强交感神经的反应性。
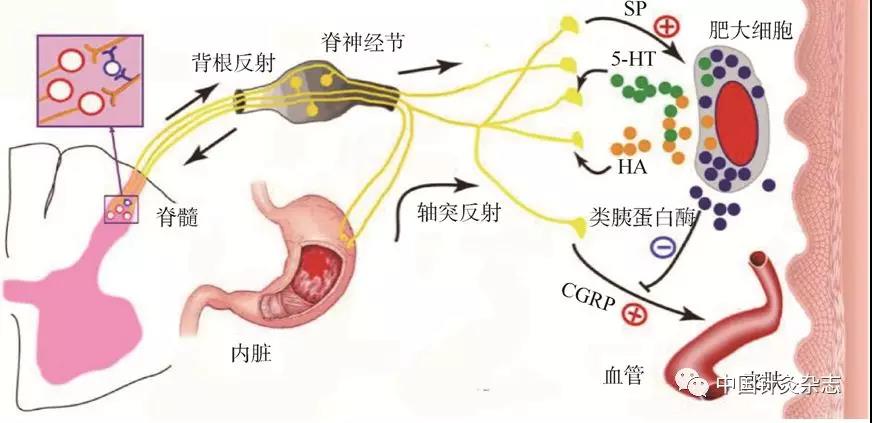
注:来自内脏的传入经背根节细胞顺向激活脊髓神经元和逆向传递至外周末梢。一方面,顺向传入到脊髓背角的冲动通过微环路中间神经元(方框内示)作用于另一个背根神经元,以背根反射的形式逆向传至外周;另一方面,内脏传入在背根节细胞的分支处,以轴突反射的形式逆向传至外周。这两种逆向传至外周的冲动均促使神经末梢释放诸如SP、CGRP等炎性物质,引起局部血管扩张和血浆白蛋白外渗;SP进一步刺激肥大细胞释放诸如HA和5-HT等致痛物质,引起穴位出现敏化现象。
图13 穴位敏化机制概图[24]
在体表医学体系中,机体状态、敏化现象和有效刺激三大因素中,机体状态,即病理过程,是唯一重要的始动因素;可以认为,缺乏人为医疗行为的干预,疾病的这种自我愈合是本能使之。当然,在敏化穴区实施有效的刺激可以激发、促进、增强和加快这种本能自愈过程。
可以说,穴位是携带“健康信息密码”的体表位域,敏化穴位是机体健康状况的“警示仪”,也是机体激发疾病“自愈”作用这一与生俱在的调控“触发器”,是以针灸为代表的体表刺激疗法发挥效应的“门控钮”。
参考文献
[1] 朱兵. 穴位可塑性: 穴位本态的重要特征[J].中国针灸, 2015, 35(1): 1203-1208.
[2] 北京医学院基础医学系针麻原理研究形态组. 家兔耳廓皮肤电阻变化与内脏疾病的关系[M]//中医研究院. 针灸研究进展. 北京: 科学出版社, 1981.
[3] 李宇清, 荣培晶, 徐卫东, 等. 条件刺激引起脊髓神经元外周感受野的变化[J]. 中国神经科学杂志, 1999, 15(4): 316-319.
[4] 喻晓春, 朱兵, 高俊虹, 等. 穴位动态过程的科学基础[J].中医杂志,2007, 48(11): 971-973.
[5] 施静, 王健, 王渊, 等. 心绞痛牵涉痛与穴位敏化的关系[J]. 针刺研究, 2018, 43(5): 277-284.
[6] 陈日新, 康明飞. 腧穴热敏化艾灸新疗法[M].北京: 人民卫生出版社, 2006.
[7] 盖国才. 穴位压痛诊断法[M]. 北京: 科学技术文献出版社,1978.
[8] 吴秀锦. 穴位的病理性反应[M]//中医研究院. 针灸研究进展.北京: 人民卫生出版社, 1981.
[9] FarmerAD, Aziz Q. Mechanisms and management of functional abdominal pain[J]. J R SocMed, 2014, 107(9):347-354.
[10]LiS, Melton DH, Li S. Tactile, thermal, and electrical thresholds in patientswith and without phantom limb pain after traumatic lower limb amputation[J]. JPain Res, 2015, 8:169-174.
[11]ChangL, Berman S, Mayer EA, et al. Brain responses to visceral and somatic stimuliin patients with irritable bowel syndrome with and without fibromyalgia[J]. AmJ Gastroenterol, 2003, 98(6): 1354-1361.
[12]曹东元, 牛汉璋, 杜剑青, 等. 穴位电刺激经大鼠初级传入反射引起内脏的神经源性炎症反应[J]. 针刺研究, 2002, 27(1): 45-49.
[13]MirandaA, Peles S, Rudolph C, et al. Altered visceral sensation in response to somaticpain in the rat[J]. Gastroenterology, 2004, 126(4): 1082-1089.
[14]MelzackR, Stillwell DM, Fox EJ. Trigger points and acupuncture points for pain:correlations and implications[J]. Pain, 1977, 3(1): 3-23.
[15]BirchS. Trigger point--acupuncture point correlations revisited[J]. J AlternComplement Med, 2003, 9(1): 91-103.
[16]DorsherPT. Can classical acupuncture points and trigger points be compared in thetreatment of pain disorders? Birch’s analysis revisited[J]. J Altern ComplementMed, 2008, 14(4): 343-345.
[17]WoolfCJ, Ma Q. Nociceptors--noxious stimulus detectors[J]. Neuron, 2007, 55(3): 353-364.
[18]WoolfCJ, Salter MW. Neuronal plasticity: increasing the gain in pain[J]. Science,2000, 288(5472): 1765-1769.
[19]LechnerSG, Lewin GR. Peripheral sensitisation of nociceptors via G-protein-dependentpotentiation of mechanotransduction currents[J]. J Physiol, 2009, 587(Pt 14): 3493-3503.
[20]HuangJ, Zhang X, McNaughton PA. Modulation oftemperature-sensitive TRP channels[J]. Semin Cell Dev Biol, 2006, 17(6): 638-645.
[21]HenrichF, Magerl W, Klein T, et al. Capsaicin-sensitive C- and A-fibre nociceptorscontrol long-term potentiation-like pain amplification in humans[J]. Brain,2015, 138(Pt 9): 2505-2520.
[22]RongPJ, Li S, Ben H, et al. Peripheral and spinal mechanisms of acupointsensitization phenomenon[J]. Evid Based Complement Alternat Med, 2013, 742195.
[23]何伟, 吴美玲, 景向红, 等. 穴位的本态: 穴位组织细胞化学的动态变化[J].中国针灸, 2015, 35(11): 1181-1186.
[24]石宏, 程斌, 李江慧, 等. 肥大细胞和P物质参与急性胃黏膜损伤大鼠体表穴位的敏化过程[J]. 针刺研究, 2010, 35(5): 323-329.
[25]HeW, Wang XY, Shi H, et al. Cutaneous neurogenic inflammation in the sensitizedacupoints induced by gastric mucosal injury in rats[J]. BMC Complement AlternMed, 2017, 17: 141.
[26]WoolfCJ. Evidence for a central component of post-injury pain hypersensitivity[J].Nature, 1983, 306(5944): 686-688.
[27]JensenTS, Finnerup NB. Allodynia and hyperalgesia in neuropathic pain: clinicalmanifestations and mechanisms[J]. Lancet Neurol, 2014, 13(9): 924-935.
[28]KunerR. Central mechanisms of pathological pain[J]. Nat Med, 2010, 16(10): 1258-1266.
[29]MengF, Ge HY, Wang YH, et al. A afferent fibers are involved in the pathology ofcentral changes in the spinal dorsal horn associated with myofascial triggerspots in rats[J]. Exp Brain Res, 2015, 223(11): 3133-3143.
[30]LatremoliereA, Woolf CJ. Central sensitization: a generator of pain hypersensitivity bycentral neural plasticity[J]. J Pain, 2009, 10(9): 895-926.
[31]LuzLL, Fernandes EC, Sivado M, et al. Monosynaptic convergence ofsomatic and visceral C-fiber afferents on projection and local circuit neuronsin lamina I: a substrate for referred pain[J]. Pain, 2015, 156(10): 2042-2051.
[32]荣培晶, 李霞, 李亮, 等. 延髓背柱核在穴位敏化现象中的作用[J]. 世界中医药, 2013, 8(3): 249-254.
[33]YuLL, Li L, Ben H, et al. Changes in responses of neurons in spinal and medullarysubnucleus reticularis dorsalis to acupoint stimulation in rats with visceral hyperalgeisa[J].Evid Based Comlement Altern Med, 2014, 2014: 768634.
[34]余玲玲, 李亮, 秦庆广, 等. 内脏伤害性传入易化穴位对大鼠脊髓广动力型神经元的激活效应[J]. 针刺研究, 2014, 39(5): 390-395.
[35]李亮, 荣培晶, 罗曼, 等. 内脏伤害性传入易化体表穴区功能的中枢机制[J]. 中国针灸, 2015, 35(11): 1187-1191.
[36]朱兵. 系统针灸学[M]. 北京: 人民卫生出版社, 2015.
(选自《中国针灸》杂志2019年第二期)
